Применение тромбоцитарной аутологичной плазмы (ТАП) в урогинекологической практике — различия между версиями
Admin (обсуждение | вклад) |
Admin (обсуждение | вклад) |
||
| Строка 218: | Строка 218: | ||
При наблюдении за пациентами отмечалось уменьшение болевой симптоматики, размягчение бляшки и уменьшение искривления полового члена, что позволило пациентам вести нормальную половую жизнь (см.рис.8, 9). | При наблюдении за пациентами отмечалось уменьшение болевой симптоматики, размягчение бляшки и уменьшение искривления полового члена, что позволило пациентам вести нормальную половую жизнь (см.рис.8, 9). | ||
| + | [[Файл:Reviewed-10.jpg]] | ||
| + | [[Файл:Reviewed-11.jpg]] | ||
[[Категория:Гинекология]] | [[Категория:Гинекология]] | ||
Версия 21:20, 19 октября 2016
Республика Казахстан, г. Алматы, ТОО «Small Clinic»
Профессор Гильязов А.Х., к.м.н. Асубаев А.Г., врач в.к. Хасанбаев Р.Т., врач в.к. Давлетбаева А.А.
Содержание
СОДЕРЖАНИЕ:
2.1 Первая стадия 2.2 Вторая стадия 2.3 Третья стадия
|
1 4 4 4 5 7 9 12 13 17 21
|
Тромбоцитарная аутологичная плазма (в дальнейшем ТАП) является частью фракции плазмы аутологичной крови, имеющей концентрацию тромбоцитов выше нормального уровня [1]. Данный метод является новым методом лечения в современной медицине, известный как "Ортобиология". Целью данной дисциплины является повышение врожденной способности организма восстанавливать и регенерировать ткани [2]. В 2009 году мировой рынок ТАП был оценен в $45 млн., и по прогнозам, к 2016 году будет составлять более $120 млн. [3]. В настоящее время нет достаточно данных подтверждающих, высокую эффективность метода, что в будущем потребует проведение крупных рандомизированных контролируемых исследований (РКИ).
В нормальном образце крови содержится 93% красных кровяных телец, 6% тромбоцитов и 1% белых кровяных телец [4]. Тромбоциты были впервые открыты в крови французским врачом Альфредом Донне в 1842 году [5]. Это небольшие дискоидные клетки с продолжительностью жизни около 7 - 10 дней. При травме, сопровождающейся повреждением сосудистой стенки, активируются тромбоциты и агрегируются вместе, после чего высвобождаются гранулы, содержащие факторы роста, которые стимулируют каскад воспалительных процессов и процесс регенерации. Тромбоциты ответственны за гемостаз, образование новой соединительной ткани, реваскуляризацию, и большая часть исследований в течение прошлого столетия была сконцентрирована на данной первичной функции [6]. Только за последние два десятилетия мы узнали, что активация тромбоцитов в организме высвобождает регенеративные белки, называемые факторами роста [7]. Существует множество факторов роста с разнообразными функциями и совокупно они могут ускорить заживление тканей и ран [8].
Обоснованием применения ТАП-терапии является полное замещение красных кровяных телец крови: содержание эритроцитов снижается до 5% (которые менее необходимы в процессе заживления) и, более того, концентрирование содержания тромбоцитов способствует образованию мощного концентрата факторов роста до 94%. Нормальный уровень тромбоцитов в крови здорового человека составляет от 150 000 до 450 000 клеток на микролитр крови. Концентрации тромбоцитов менее 1000 × 106/мл не способствует улучшению заживления ран [9], и большинство исследований показали, что регенеративная эффективность тканей при применении ТАП повышает концентрацию тромбоцитов как минимум в 5 раз (приблизительно 1 миллион тромбоцитов/мкл) [10], в то время как более высокие концентрации не показали преимущества в улучшении заживления ран. Не решенным остается вопрос об идеальной концентрации тромбоцитов. Также существует большая вариация оборудования и методик используемых при концентрировании тромбоцитов [11], различные исследования могут отличаться характеристиками дегрануляции тромбоцитов, которые влияют на клинические результаты [12, 13, 14] что затрудняет интерпретацию результатов.
Важными компонентами ТАП являются: -Трансформирующий Фактор Роста (TGF) -β, -Тромбоцитарный Фактор Роста (PDGF-AB и PDGF-BB), -Инсулиноподобный Фактор Роста (ИФР), -Эндотелиальные Факторы Роста (VEGFs), -Эпидермальный Фактор Роста (EGFs), -Фактор Роста Фибробластов (FGF) -2 [12, 15, 16]. TGF-β1 и PDGF стимулируют пролиферацию мезенхимальных клеток. TGF-β1 также стимулирует продукцию внеклеточного матрикса, включая коллаген. Данные факторы стабилизируют поврежденные ткани во время начальных стадий регенерации, а также направляют местные мезенхимальные и эпителиальные клетки при мигрировании, делении, и увеличивают синтез коллагена и матрицы, в конечном счете, приводя к образованию фиброзной соединительной ткани и рубцов [17].
VEGF и FGF-2 имеют важное значение в стимуляции образования новых кровеносных сосудов, для доставки питательные веществ и клеток-предшественников в очаг повреждения; однако, для полного процесса неоваскуляризации требуются дополнительные факторы. [18]. Гормон ИФР, состоящий из 70 аминокислот, является нормальным компонентом плазмы и транспортируются ИФР-связывающими белками [19, 20, 21]. Содержание ИФР-1 в тромбоцитах не однозначно, в нескольких протеомических исследованиях описано его отсутствие, а в большинстве литературных источниках ИФР- 1 обнаружен в тромбоцитах [22, 23, 24]; тем не менее, большинство исследований обнаружили ИФР-1 в ТАП [25, 26, 27]. Роль ТАП в участии различных механизмов регенерации, заслуживает должного внимания в качестве дополнительной терапии для конкретных случаев.
Патогенетические механизмы действия тромбоцитарной аутологичной плазмы
Биологический аспект технологии «Плазмолифтинг» (Plasmolifting™) указывает на схожесть патологического механизма с образованием артериального «белого» тромба. И в том, и в другом случае морфологическим субстратом являются тромбоциты и лейкоциты (Ахмеров Р.Р., Зарудий Р.Ф.). Однако технология «Плазмолифтинг» (Plasmolifting™) подразумевает минимальное присутствие лейкоцитов, особенно нейтрофилов [28]. Приведенные ниже сведения, с нашей точки зрения, помогут понять более глубинный механизм действия аутологичной плазмы на ткани. Применение тромбоцитарной аутологичной плазмы на сегодняшний день широко распространено в различных областях медицины. В большинстве своем это патологии, характеризующиеся хроническим длительно протекающим воспалением с периодами обострения. Так, например, угревая сыпь, хронический генерализованный или локализованный пародонтит, гингивит, периимплантит, эндоцервицит и т.п. [29, 30, 31, 32, 33, 34, 35]. Таким образом, это ткани экто- и эндодерамального происхождения (эпидермальные и соединительные ткани) с застойными явлениями воспаления, характеризующиеся формированием диффузной или очаговой мононуклеарной инфильтрации. В таких тканях по причине снижения резервных сил и нарушения местных механизмов иммунитета: не происходит эффективной пролиферации клеток в очаге воспаления, завершающейся репарацией тканей, а происходят вторичное повреждение (альтерация) тканей, вызванное клетками самого очага хронического воспаления, и образование порочного круга [36, 37, 38, 39, 40, 41].
Первая стадия: реакция сосудистой стенки
Воспаленные ткани обычно характеризуются поврежденным эндотелием, а значит, расстройством кровообращения. Реакция поврежденной сосудистой стенки выражается в вазоконстрикции, возникновение которой в крупных сосудах связано с нервно-рефлекторным механизмом, а в капиллярах — с сокращением миофибрилл эндотелиальных клеток. Сокращение сосудистой стенки может стимулироваться вазоактивными субстанциями, высвобождающимися из адгезированных к месту повреждения тромбоцитов: серотонином, адреналином, тромбоксаном А2. В свою очередь брадикинин, активирующий фактор XII, может способствовать усилению проницаемости капилляра и сдавлению его извне вышедшей жидкостью.
В реакциях поврежденной сосудистой стенки немаловажную роль выполняет также и сам эндотелий, способный продуцировать как анти- тромбогенные, так и тромбогенные факторы [42, 43, 44, 45, 46].
Вторая стадия: адгезия тромбоцитов
Адгезия (прилипаемость) тромбоцитов к волокнам коллагена разрушенной сосудистой стенки происходит в первые секунды после повреждения. Этот процесс обусловлен прежде всего физиологическими механизмами реакции тромбоцитов на травму за счет рецепторов, выполняющих роль посредника между тромбоцитом и различными факторами внешней среды [42, 43, 45].
Большинство рецепторов, фиксированных на цитоплазматической мембране тромбоцита, являются гликопротеинами (ГП или ОР) Один конец молекулы рецепторных ГП находится во внеклеточном пространстве, а другой пронизывает мембрану и контактирует со структурами тромбоцита, расположенными на внутренней стороне цитоплазматической мембраны. На наружных частях ГП молекул располагаются рецепторные локусы, специфичные для разных веществ (лигандов). После соединения рецепторных локусов с лигандами создается сигнал активации, передающийся к внутренним частям тромбоцитов.
Лиганды — вещества, которые могут специфически взаимодействовать с рецептором, вызывать его конформационные изменения и таким образом модулировать функциональную активность тромбоцита. Каждый рецептор имеет один или несколько физиологических агонистов и может связывать их с высокой или с низкой аффинностью [42, 43, 44, 47].
Непосредственно адгезия тромбоцитов к субэндотелиальным волокнам коллагена происходит благодаря наличию на тромбоцитах рецептора к коллагену — гликопротеида Iа-IIa, относящегося к семейству интегринов, а стабилизация образовавшегося соединения устанавливается фактором Виллебранда, который образует связь между субэндотелиальными волокнами коллагена и рецептором тромбоцита гликопротеидом Ib- IX [42, 43, 48].
Третья стадия: активация и дегрануляция тромбоцитов
Как уже было указано выше, активация тромбоцитов происходит субэндотелиальными структурами стенки сосуда (коллагеном и микрофибриллами) за счет адгезии, что приводит к изменению дисковидной формы тромбоцитов на сферическую, образованию у них отростков (псевдоподий тромбоцитов). Коллаген-индуцированная агрегация тромбоцитов имеет достаточно выраженную латентную фазу и может составлять 5—7 мин [49, 48].
Реакцией высвобождения называется избирательное выделение из агрегированных тромбоцитов некоторых соединений, находящихся в гранулах, при сохранении целостности клетки. Характерно, что секреция содержимого гранул в плазму не сопровождается лизисом клетки, при котором разрушаются мембраны и органеллы вместе со своим содержимым выходят в окружающую среду. При реакции высвобождения гранулы выбрасывают свое содержимое при помощи сокращения микротубулярной системы, связанной с поверхностью клетки, причем тромбоциты сохраняют целостность или во всяком случае способность к выполнению своих функций [42, 45].
Условно реакцию высвобождения разделяют на несколько стадий: индукцию — влияние различных соединений (коллагена, тромбина и других факторов) на мембрану, стимулирующих ее и приводящих к освобождению Са2+ из мембраны, и трансмиссию — проникновение Са2+ в клетку [50, 51, 42].
В последние годы установлено, что Са2+ играет ключевую роль в функциональной активности тромбоцитов. Существует ряд доказательств в пользу этого положения — прежде всего аналогия с другими клетками, для которых известно, что Са2+ является возбудителем секреции и сокращения. К непрямым доказательствам относится известный факт, что адгезия и секретирование содержимого гранул тромбоцитов индуцируются катионным ионофором А23187, причем ответ на действие этого соединения такой же, как и при действии других стимулов. И наконец к прямым доказательствам можно отнести блокирование лекарственными средствами (некоторыми локальными анестетиками) функциональной активности кровяных пластинок наряду с ингибированием высвобождения Са2+ из саркоплазматического ретикулума. Несмотря на то что окончательно экспериментально это не доказано, предполагают, что в регуляции функций тромбоцитов основную роль играют внутриклеточные ресурсы Са2+ [50, 51].
При увеличении концентрации Са2+ в цитоплазме высвобождается Са2+ из мембраны, что приводит к быстрому изменению формы тромбоцитов, затем везикулярные органеллы выделяют Са2+ в цитоплазму и индуцируют реакцию высвобождения, причем происходят секреция Са2+ в окружающую среду и изменения в плазматической мембране, которые выражаются в увеличении проницаемости для Са2+. При высвобождении Са2+ из плотных гранул мембрана этих органелл соединяется с плазматической мембраной или с мембраной канальцевой системы, связанной с поверхностью клетки, которая, сокращаясь, выталкивает Са2+ и некоторые другие соединения в цитоплазму [50, 51, 42, 45].
В связи с тем, что регуляция уровня Са2+ обеспечивает контрактильное состояние клетки, активность сократительного механизма, необходимого для агрегации, реакции высвобождения, ретракции кровяного сгустка, было проведено большое число исследований с целью выявления рецепторов для Са2+ в тромбоцитах. К весьма существенным результатам этих исследований следует отнести выделение из лизатов тромбоцитов четырех белков (меченных 32Р-АТР), связывающих Са2+ (молекулярная масса 50 000, 28 000, 15 000 и 11 000 дальтон). Наибольшее включение метки обнаружено во фракции белка с молекулярной массой 11 000 дальтон, причем только этот белок из четырех рецепторов метился 32Р в неповрежденных тромбоцитах. Он локализован на поверхности клетки и связывает 1 моль Са2+ на 1 моль фосфорилированного белка [50, 51, 48].
Результатом активации является высвобождение из них ряда веществ, служащих сильными стимуляторами тромбоцитов (аденозиндифосфат, серотонин, адреналин, нестабильные простагландины, тромбоксан А2, тромбоцитоактивирующий фактор).
Адреналин, коллаген и тромбин, связываясь с мембранными рецепторами, активируют два мембранных фермента — фосфолипазу С и фосфолипазу А2. Эти ферменты катализируют расщепление двух мембранных фосфолипидов: фосфатидилинозитол-4,5-дифосфата и лецитина, — с образованием арахидоновой кислоты. Сначала небольшое количество арахидоновой кислоты превращается в тромбоксан А2, который, в свою очередь, активирует фосфолипазу С. Образование тромбоксана А2 из арахидоновой кислоты катализируется циклооксигеназой.
При гидролизе фосфатидилинозитол-4,5-дифосфата образуются ди- ацилглицерин и инозитол 1,4,5-трифосфат. Инозитол 1,4,5-трифосфат вызывает выброс в цитоплазму кальция, что запускает фосфорилирование легких цепей миозина. Взаимодействие миозина с актином обеспечивает перемещение гранул и изменение формы тромбоцита [44, 48].
Диацилглицерин активирует протеинкиназу С, которая фосфорили- рует ряд белков, в том числе киназу легких цепей миозина и плекстрин (белок массой 47 000). Предполагается, что фосфорилирование этих или других белков также регулирует дегрануляцию тромбоцитов [52].
Тромбоксан А2, образующийся из арахидоновой кислоты в тромбоцитах, стимулирует их активацию, а простациклин (простагландин 12), образующийся из той же кислоты в эндотелии, подавляет активацию тромбоцитов (за счет повышения уровня циклического аденозинмоно- фосфата [44, 48].
Заключительной фазой реакции высвобождения является секреция, которая протекает в два этапа: выход содержимого из плотных телец (главным образом серотонина, АЛР, Са2+) и секреция из а-гранул тромбоцитов ФР, способных запускать процессы регенерации, а также АТР, фактора 4, способного присоединять и нейтрализовать гепарин, фактора III, катализирующего конечную стадию свертывания — образование фибрина, а также секреция Са2А липидов и некоторых гидролаз: в следовых количествах. Ферменты, находящиеся в цитоплазме, митохондриях и мембране, клеткой удерживаются [50, 51, 44, 53].
Поэтому становится очевидным тот факт, что при введении тромбоцитарной аутологичной плазмы (ТАП) в определенную зону происходят те же процессы адгезии тромбоцитов и высвобождение соответствующих ФР из α-гранул, что и в норме.
В настоящее время накоплен достаточный объем знаний о применении технологии «Плазмолифтинг» (Plasmolifting™) в косметологии, травматологии, дерматологии. Кроме того, технология начинает применятся и в других областях медицины.
Целью данного исследования является описание опыта применения технологии «Плазмолифтинг» (Plasmolifting™) в лечении различных заболеваний мочеполовой системы.
Материал и методы
Технология «Плазмолифтинг» (Plasmolifting™)
Забор крови осуществляется в объеме 18-35мл с помощью периферического венозного катетера диаметром не менее 1,1 мм в зависимости от зоны введения, определенной для лечения, в 2-4 специализированные пробирки «Плазмолифтинг» (Plasmolifting™).
Пробирки укладываются в центрифугу, которая настраивается на параметры вращения 3200 оборотов в минуту в течение 5 минут, или 1000G. В ходе вращения в центрифуге кровь разделяется на две основные фракции: эритроцитарно-лейкоцитарный сгусток и плазму крови, содержащую тромбоциты, микро- и макроминералы, витамины, аминокислоты.
Шприцем (2,0-3,0 мл) забирается супернатант - тромбоцитарная аутологичная плазма, находящаяся в верхней части пробирки над разделительным гелем.
Материал исследования
Исследование было проведено в период с августа 2015 г. по сентябрь 2016г. В исследование было включено 155 больных с различной урологической патологией:
1. 86 пациентов с кистозными заболеваниями почек, из них:
1.1 простые кисты почек - 78 больных;
1.2 поликистоз почки – 6 больных;
1.3 мультилакунарные кисты почки- 2 пациента;
2. Кисты придатков яичка -18 пациентов;
3. Пациенты с хроническими циститами – 16 пациентов;
4. Хронические простатиты и уретриты – 12 пациентов;
5. Недержание мочи – 6 женщин;
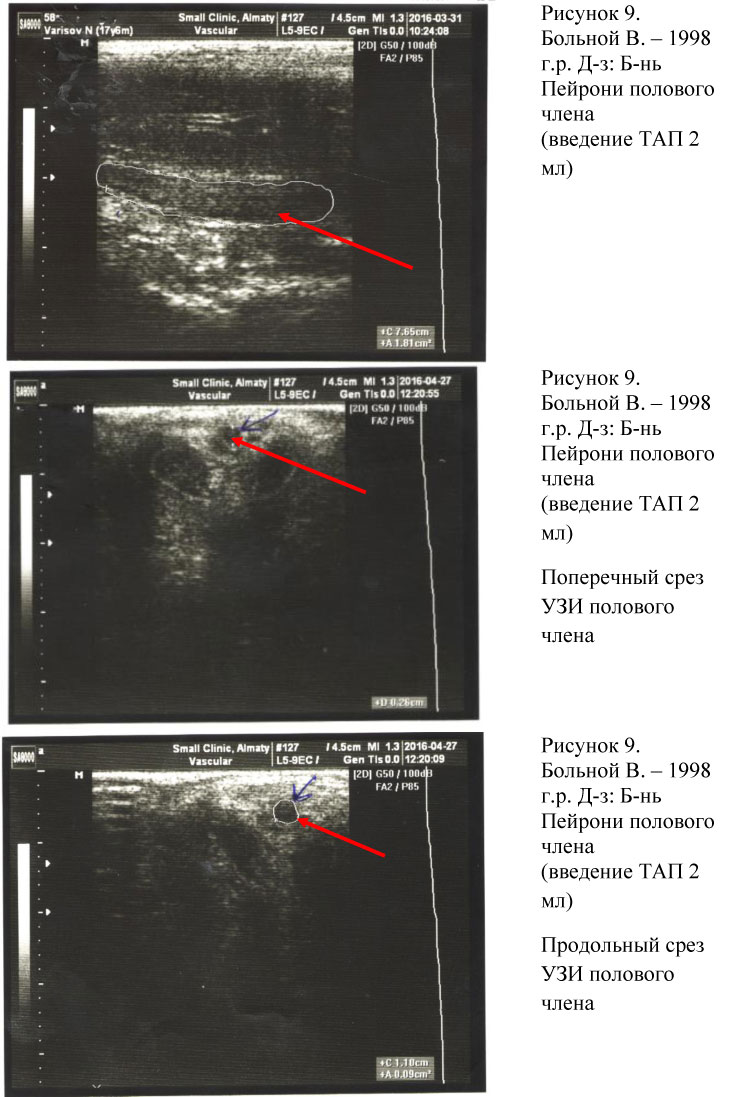
6. Пациенты с болезнью Пейрони – 6 пациентов;
7. Пациенты с водянкой оболочек яичка (гидроцеле) – 8 пациентов;
8. Пациенты с хроническими пиелонефритами – 2 пациента;
9. Пациент с склерозирующим лишаем головки полового и стриктурой ладьевидной ямки уретры – 1.
Введение ТАП после перенесенного острого пиелонефрита, т.е. в стадии неполной ремиссии заболевания. Введение ТАП проводилось под контролем УЗИ в трех точках вокруг почки в околопочечную клетчатку.
Пациенты с кистозными заболеваниями почек наблюдались в 4 визита (на 7, 10, 30, 60 дни) после пункции. Пациентам на 1 визите проводилась чрескожная пункция кист почек под УЗИ контролем с аспирацией их содержимого и введением в полость ТАП. Оценка эффективности проводилась методом УЗИ почек при каждом последующем визите.
Пациенты с кистами придатков яичек >5 мм (3 пациента) проходили пункцию кист с последующим введением ТАП в ткани вокруг кисты, с кистами <5 мм (5 пациентов) проводилось обкалывание зоны вокруг кист, наблюдение проводили на 10, 30 дни после пункции методом УЗИ.
Пациенты с диагнозом хронический цистит, после проведения курса антибактериальной и противовоспалительной терапии проходили курс внутрипузырных инстилляций ТАП для восстановления уроэпителиального слоя мочевого пузыря. Инстилляции проводились 6 раз каждые 3 дня, наблюдение проводилось в течение 6 месяцев.
Пациентам со стрессовым недержанием мочи проводилось армирование стенки мочеиспускательного канала мезонитями в нижней и средней трети уретры, комбинированно проводилась инъекция ТАП вокруг сфинктера мочевого пузыря в 6 точках трансвагинальным доступом. Повторные осмотры проводились каждые 3 месяца в течение 9 месяцев. Повторное введение ТАП проводилось через 6-8 месяцев.
Пациентам с болезнью Пейрони с размером бляшек от 1 до 3 см и углом искривления полового члена не более 30º проводилась инъекция ТАП вокруг бляшки в 4 точках каждые 4 дня от 4 до 6 процедур, наблюдение за пациентами проводилось в течение 9 месяцев каждые 90 дней.
Пациенты с хроническим простатитом и уретритом проходили курс комбинированной антибактериальной терапией и ТАП. Аутологичная плазма вводилась с помощью уретрального катетера непосредственно в простатический отдел уретры с частотой каждые 3 дня, проводились 4-5 процедур.
Пациентам с гидроцеле после аспирации жидкости под контролем УЗИ, проводилось 4 процедуры инъекции ТАП в межоболочечное пространство каждые 7 дней, пациенты наблюдались в течение 3 месяцев.
Результаты исследования
Перед проведением процедуры всем пациентам с кистозными заболеваниями почек проводилось полное клинико-лабораторное обследование, позволяющее оценить функциональное состояние почек и провести визуализацию почек методами УЗ диагностики и КТ.
Из 86 пациентов у 78 был верифицирован диагноз солитарных кист одной из почек, у 6 пациентов солитарные кисты обеих почек, у 6 пациентов поликистоз почек, у 2-х больных – мультилакунарные кисты почек.
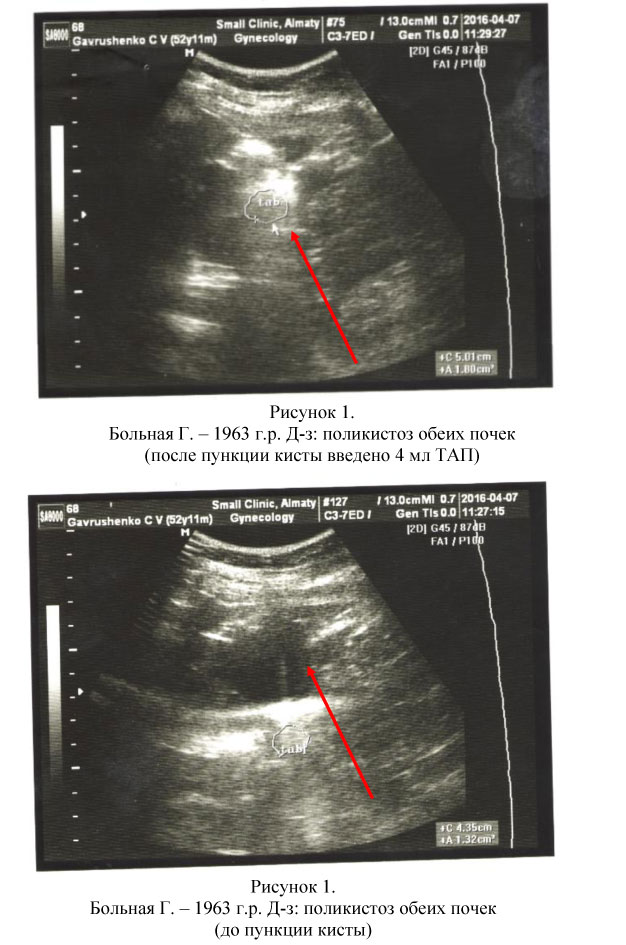
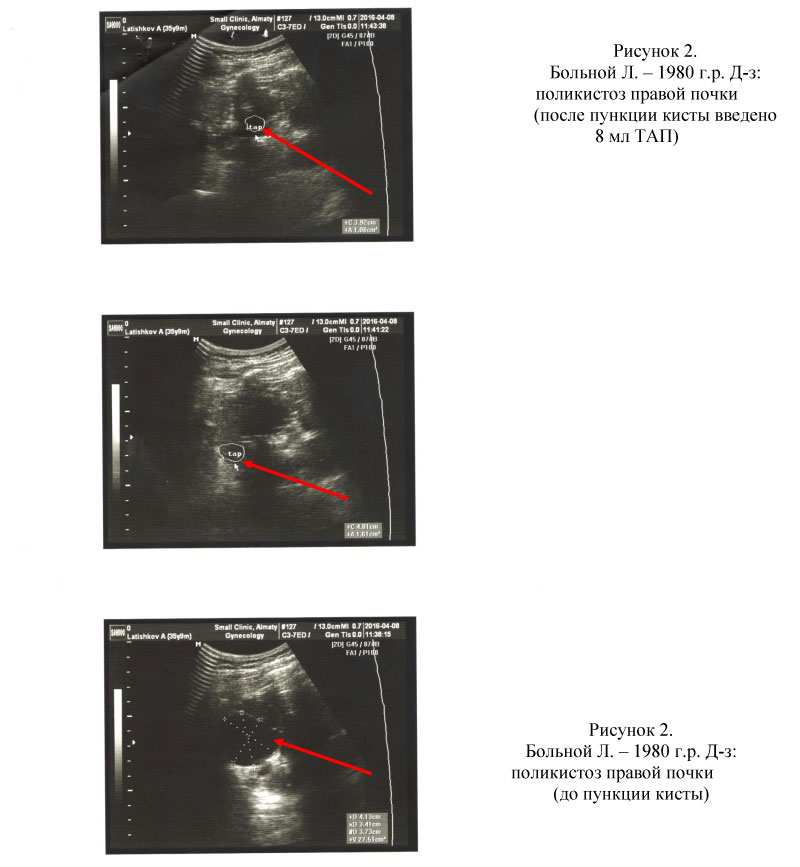
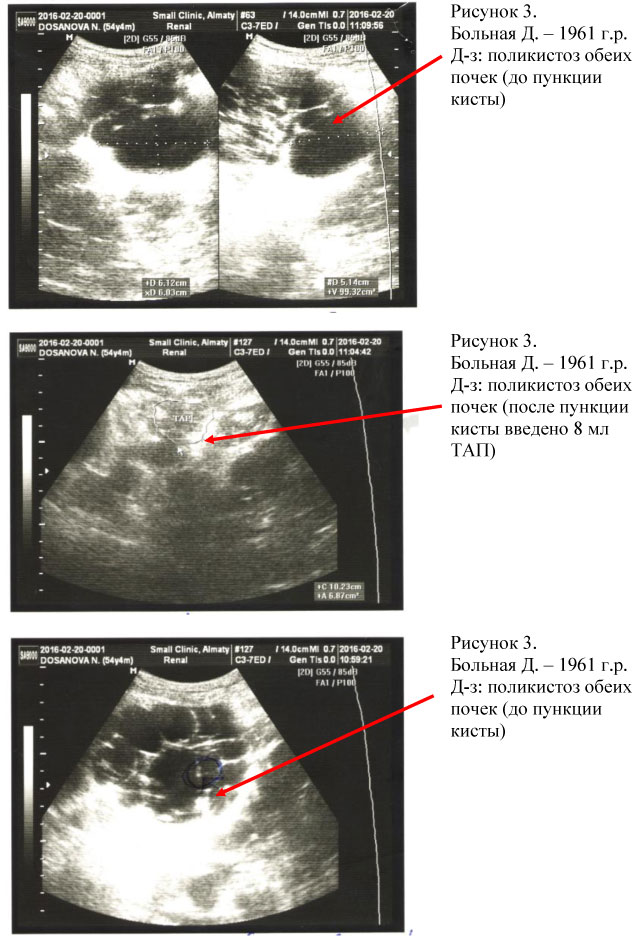
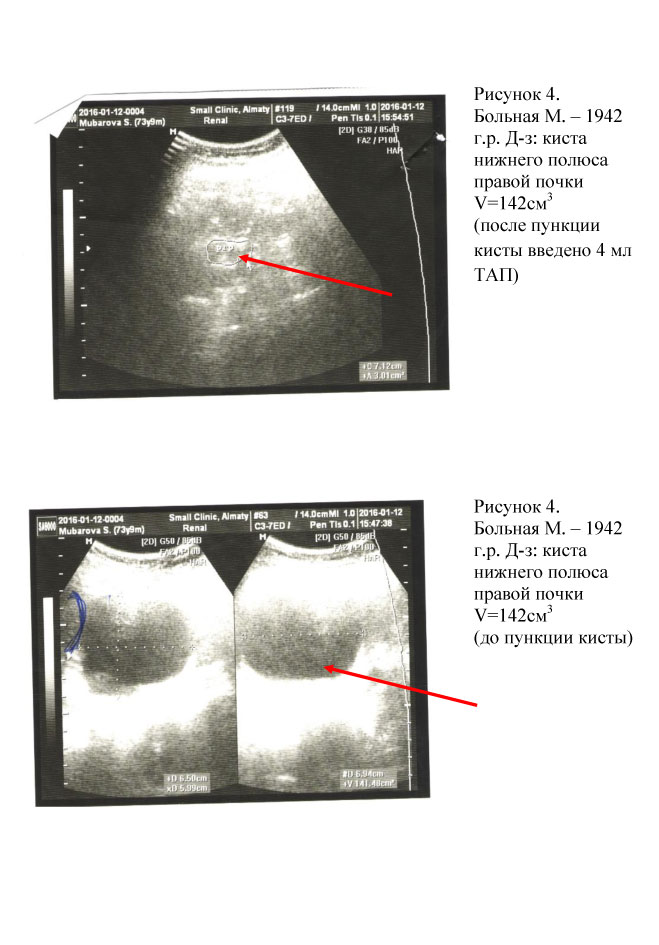
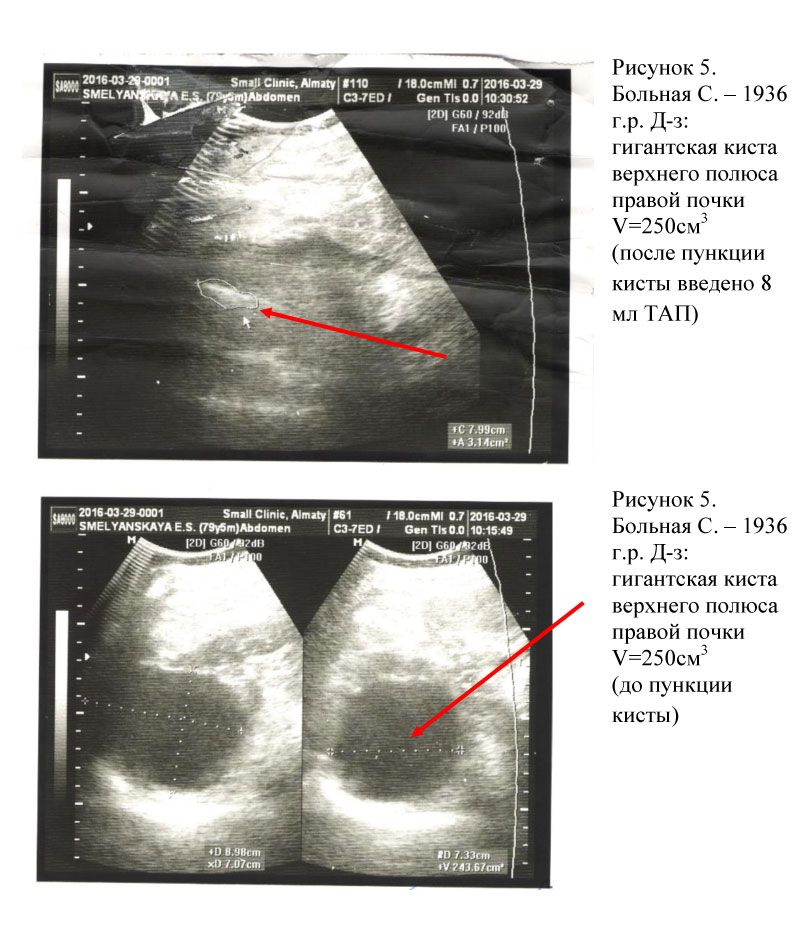
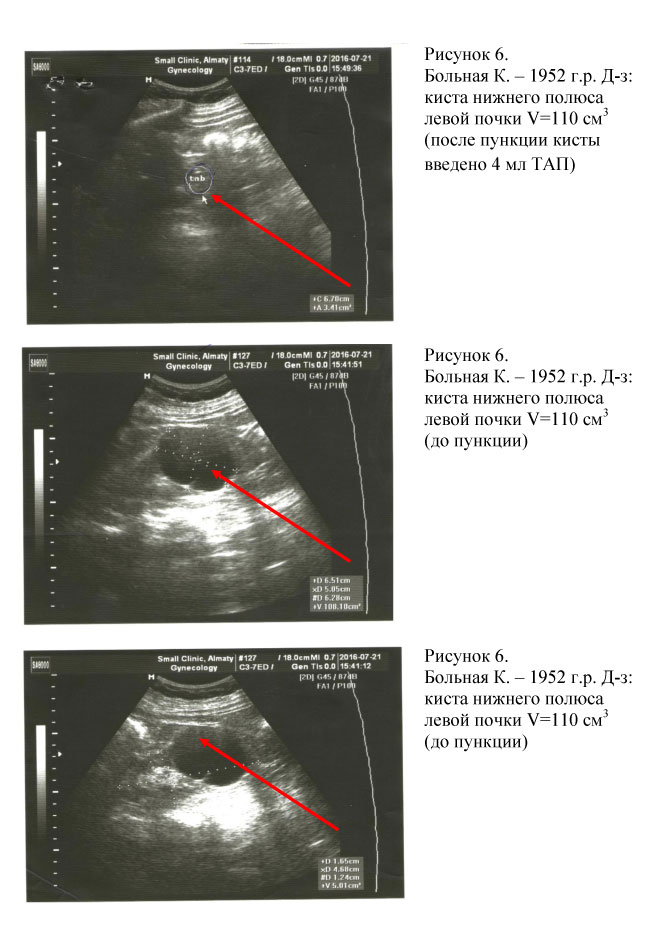
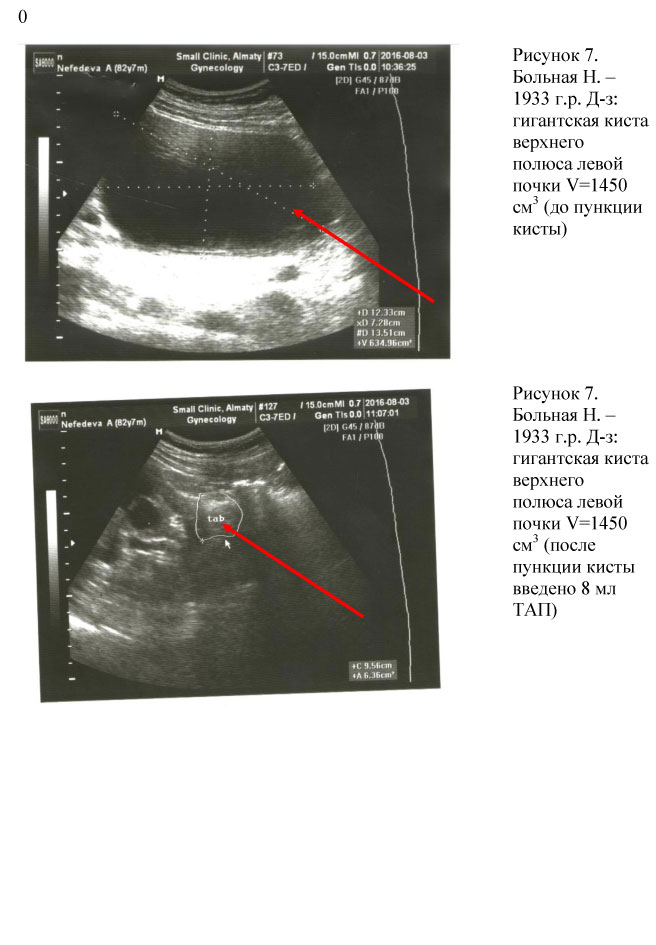
Всем пациентам при первичном визите проводилась пункция кист почек с аспирацией их содержимого. При поликистозе почек проводилась пункция кист наибольшего размера с целью декомпрессии паренхимы почек с последующим введением ТАП в полость кист (см. рис. 1, 2, 3, 4, 5, 6, 7). Процедура пункции кист почек проводилась амбулаторно под местной инфильтрационной анестезией.
При последующем наблюдении у большинства пациентов послеоперационный период протекал без осложнений. Осложнения после пункции и введения ТАП наблюдались у 4-х больных. У трех пациентов произошло кровоизлияние в полость кисты на 10 сутки, что было связано с несоблюдением режима: поднятие тяжести, физические упражнения. Одному пациенту проведено оперативное лечение, двум пациентам - повторная пункция кист почек через 2-3 месяца с хорошими результатами. У одного пациента наступил рецидив кисты почки после пункции и введения ТАП, через 4 месяца проведена повторная пункция с хорошим результатом. Всем остальным пациентам проводилось контрольное исследование (общие анализы мочи и крови, биохимических показателей функции почек).
У 78 пациентов при наблюдении в течение 2 месяцев, рецидивов кист не наблюдалось.
У 18 пациентов из 8 с кистами придатков яичек отмечался сопутствующий эпидидимит. Предварительно после полного клинико- лабораторного обследования, пациентам проводилась антибактериальная и противовоспалительная терапия. После купирования воспалительного процесса пациенты с кистами >5 мм подвергались пункции кист придатков с введением ТАП в ткань придатка вокруг кист. При кистах придатков < 5мм проводилась инфильтрация тканей придатка вокруг кист. Процедура проводилась 4 кратно каждые 7 суток с наблюдением за результатом лечения методом УЗИ диагностики.
Оценка результатов лечения проводилась в течение 1 месяца, в течение которых пациенты приходили на прием 2 раза, на 10 и 30 сутки. При контроле методом УЗИ на 10 сутки после 4-й процедуры у 4 пациентов с кистами <5 мм наблюдался рост кист до 6 мм в диаметре, что требовало пункцию кист придатков, с повторением курса терапии. В период наблюдения за данной категорией пациентов в течение дополнительного месяца рецидива кист не наблюдалось.
16 пациенток с хроническим циститом имели длительный анамнез данного заболевания (от 3 до 8 лет). Ежегодно пациентки отмечали от 2 до 5 эпизодов обострения заболевания. После полного клинико-лабораторного обследования пациенток, проводился курс антибактериальной терапии согласно чувствительности микроорганизмов. После курса медикаментозной терапии, проводилась инстилляция ТАП каждые 3 дня, всего 6 процедур. Введение ТАП не сопровождалось отрицательными ощущениями со стороны пациенток.
При последующем наблюдении в течение 6 месяцев, пациентки отмечали значительное улучшение субъективных ощущений, рецидивов заболевания в период наблюдения не отмечалось. Контрольные анализы бактериологического исследования мочи через 3 и 6 месяцев после лечения показали значительную санацию мочевыводящих путей.
6 пациенток со стрессовым недержанием мочи проходили полное лабораторно-инструментальное обследование. При проведении первичной цистоскопии у всех пациенток наблюдалось зияние шейки мочевого пузыря и наружного отверстия уретры, а также укорочение длины мочеиспускательного канала. В качестве комплексного лечения, первым этапом проводилось армирование стенки уретры мезонитями трансвагинально из 6 точек, с целью укрепления стенки мочеиспускательного канала, ограничение его патологической подвижности и восстановление его длины. Вторым этапом проводилась инъекция ТАП в область сфинктера мочевого пузыря в 6 точках, что позволяло полностью коррегировать зияние шейки мочевого пузыря под контролем цистоскопии.
Сразу после процедуры пациентки при кашлевой пробе отмечали полное удержание мочи. В течение последующих 3 месяцев пациентки проходили курс упражнений Кегеля, с целью усиления тонуса мускулатуры тазового дна и получали вагинально свечи с эстрогенами, инстилляции мочевого пузыря с раствором дриптана с целью предупреждения осложнений.
При повторном осмотре и цистоскопии через 3 месяца у 5 пациенток отмечалось частичное зияние шейки мочевого пузыря, также пациентки начиная со второго месяца, отмечали периодическое частичное недержание мочи. Всем пациенткам повторно проводились процедуры инъекции ТАП в область сфинктера мочевого пузыря каждые 3 месяца (3 процедуры).
В период наблюдения за пациентками в течение 9 месяцев, эпизодов недержания мочи не наблюдалось, процедура в целом переносилась хорошо, без каких- либо осложнений.
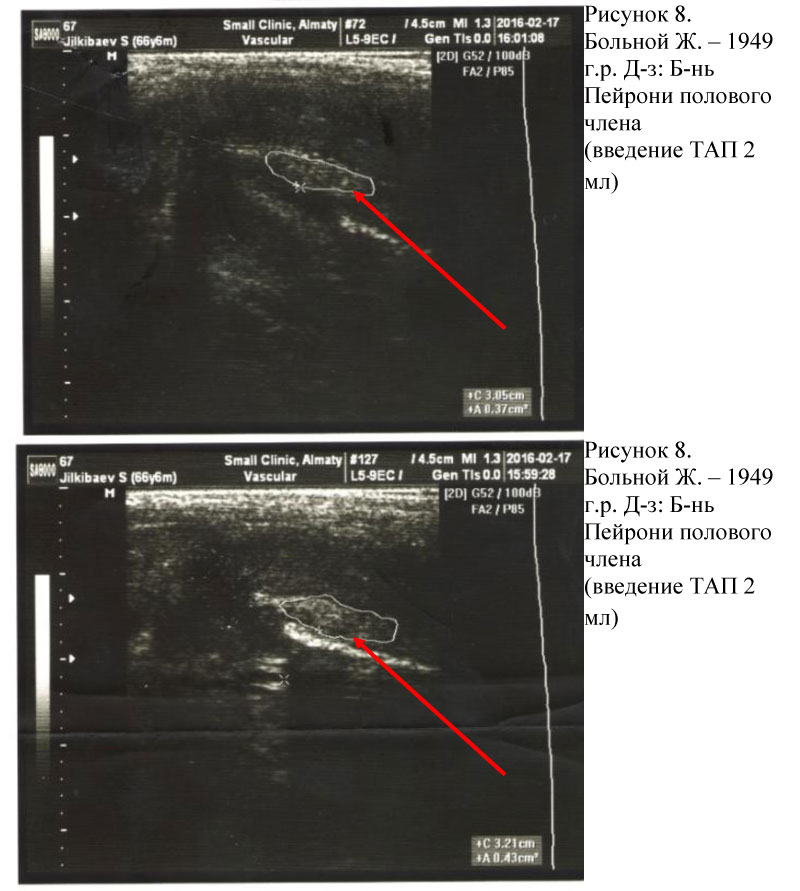
6 пациентов с болезнью Пейрони имели размер бляшек от 1 до 3 см, у всех пациентов бляшка находилась на дорзальной поверхности кавернозных тел. Искривление полового члена не превосходило 30º. Начало заболевания пациенты отмечали в течение 1- 2 лет, лечение ранее не проходили.
Курс проводимой терапии включал инъекцию ТАП вокруг бляшки в 4 точках, электрофорез лидазой и антиоксидантную терапию витамином Е. Инъекции ТАП проводили каждые 4 дня от 4 до 6 процедур. Наблюдение за пациентами проводилось в течение 9 месяцев каждые 3 месяца.
При наблюдении за пациентами отмечалось уменьшение болевой симптоматики, размягчение бляшки и уменьшение искривления полового члена, что позволило пациентам вести нормальную половую жизнь (см.рис.8, 9).